【领先世界】华东师范大学 | 超高活性基因编辑器
团队经过两年多的艰苦攻关,成功打破现有碱基编辑技术效率瓶颈,通过融合单链DNA结合蛋白的功能域开发了一系列超高活性的新型胞嘧啶碱基编辑器(命名为:hyCBE)。相对于已报道的 CBE,在人类细胞系及小鼠胚胎中其活性均显著提高并可以编辑到靠近 PAM 区的碱基。更令人振奋的是,活性的提高并没有增加DNA及RNA脱靶风险,并且在基因治疗等表现出非常广阔的应用前景。相关成果于2020年5月11日在线发表于国际著名学术期刊Nature Cell Biology。
实验室
一、项目背景
近年多个国家陆续批准了治疗腺苷脱氨酶(ADA)缺乏性重度联合免疫缺陷症、脊髓性肌萎缩症、β地中海贫血和莱伯氏先天性黑蒙症等遗传病的基因治疗药物。由于技术限制,已上市的药物存在不能长期有效或者诱发肿瘤的风险,因此科学家们不断开发新的基因改造的技术,期望能够克服现有技术的不足,实现一次治疗终身治愈。
以2012年发明的CRISPR/Cas9系统为代表的基因编辑技术是近年来最为火热的分子生物学技术之一。华东师大生命科学学院课题组于2013年在国际上率先建立了大鼠和小鼠胚胎的Cas9基因编辑技术,将基因修饰动物构建的时间由传统方法的18个月缩短到5周左右,解决了基因治疗研究中必不可少的疾病模型构建的问题。随后利用Cas9技术修复了动物模型中的单个碱基突变,治愈了B型血友病,证明其在遗传疾病治疗中的潜力。然而,Cas9技术精确修复碱基突变的效率非常低,只有1%左右,很难在更多的疾病治疗中推广。
2016年美国科学家开发的CBE技术,能在不产生DNA双链断裂的前提下,直接将目的片段一定范围内的胞嘧啶转化成胸腺嘧啶,实现C/G碱基对向T/A碱基对的转换。今年年初,华东师大团队发表论文,成功地利用CBE技术建立了人类造血干细胞单碱基编辑技术体系,证明CBE有治疗β地中海贫血的潜力,但存在编辑效率偏低、精准度有限等阻碍临床应用的问题。
二、技术简介
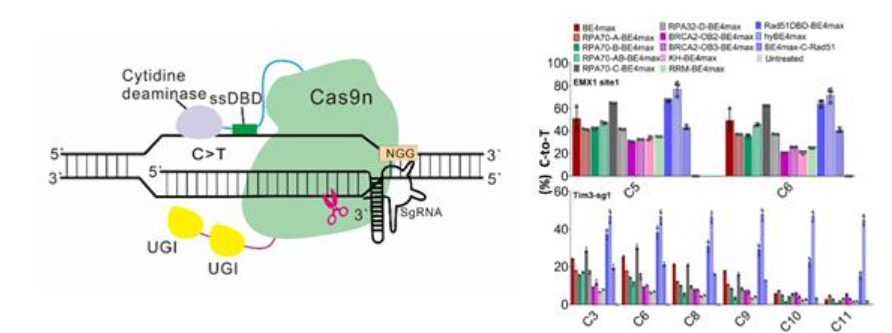
该研究将Rad51蛋白的单链DNA结合结构域融合到Cas9与脱氨酶之间,极大地提高了胞嘧啶碱基编辑器(CBE)的编辑活性,拓宽编辑窗口,因此将其命名为超高活性CBE(hyBE4max);类似地还改造出具有更宽的编辑窗口和更高活性的hyA3A-BE4max,以及能更高效识别TC碱基模块中的C(胞嘧啶)而不引起其他C突变的hyeA3A-BE4max。
以hyeA3A-BE4max为例,在所检测的靶点中,特定位点的编辑活性最高提高了257倍。通过胚胎显微注射,能在胚胎中精确改变单个碱基,直接获得杜氏肌营养不良(DMD)小鼠模型,平均效率提高了近60倍。除了能快速精确构建遗传疾病动物模型,hyeA3A-BE4max在β地中海贫血的治疗中也展现了显著的优势,实现真正单个碱基的突变,体外实验证明有更好的治疗效果。一系列严格的实验表明,这一新编辑器具有非常高的精确性,没有检测到明显的DNA和RNA脱靶,证明了新编辑工具用于基因治疗的巨大潜力。
团队研发的超高活性碱基编辑技术基本解决了现存问题,有望成为遗传疾病治疗的首选碱基编辑器。

打开微信
“扫一扫”

